Auch wenn der Klimaschutz zurzeit in den Hintergrund gerückt ist: Die Zeit drängt! Im Jahr 2024 wurde erstmals die 1,5-Grad-Marke der globalen Durchschnittstemperatur gebrochen1. Wir alle müssen etwas dagegen tun. Das Fraunhofer IGB macht es. In zwei kürzlich erschienen wissenschaftlichen Publikationen zeigen wir Routen, wie CO2 über Methanol als mikrobielles Substrat in industriell wichtige Grundbausteine für Polymere umgesetzt werden kann. Im Biointelligenz-Blog fassen wir eine der Veröffentlichungen zusammen, die einen Meilenstein der fermentativen Glycolsäure-Produktion des Fraunhofer IGB darstellt.
Wie sich aus CO2 über Ameisensäure oder Methanol wirtschaftlich interessante Chemikalien und Materialien herstellen lassen, fasst der letzte Beitrag dieser Reihe zusammen. Heute resümieren wir unsere Veröffentlichung »A novel engineered strain of Methylorubrum extorquens for methylotrophic production of glycolic acid«, die am 23. Dezember 2024 in der Fachzeitschrift Microbial Cell Factories (Springer Nature) erschienen ist. Diese Publikation entstand in Kooperation mit Dr.-Ing. Steffen Klamt vom Max-Planck-Institut für Dynamik komplexer technischer Systeme.
Am Anfang steht eine entscheidende Frage: Wie können wir mithilfe von Mikroorganismen und biotechnologischen Prozessen aus CO2-basierten Substraten wie Methanol zahlreiche chemische Wertstoffe gewinnen?
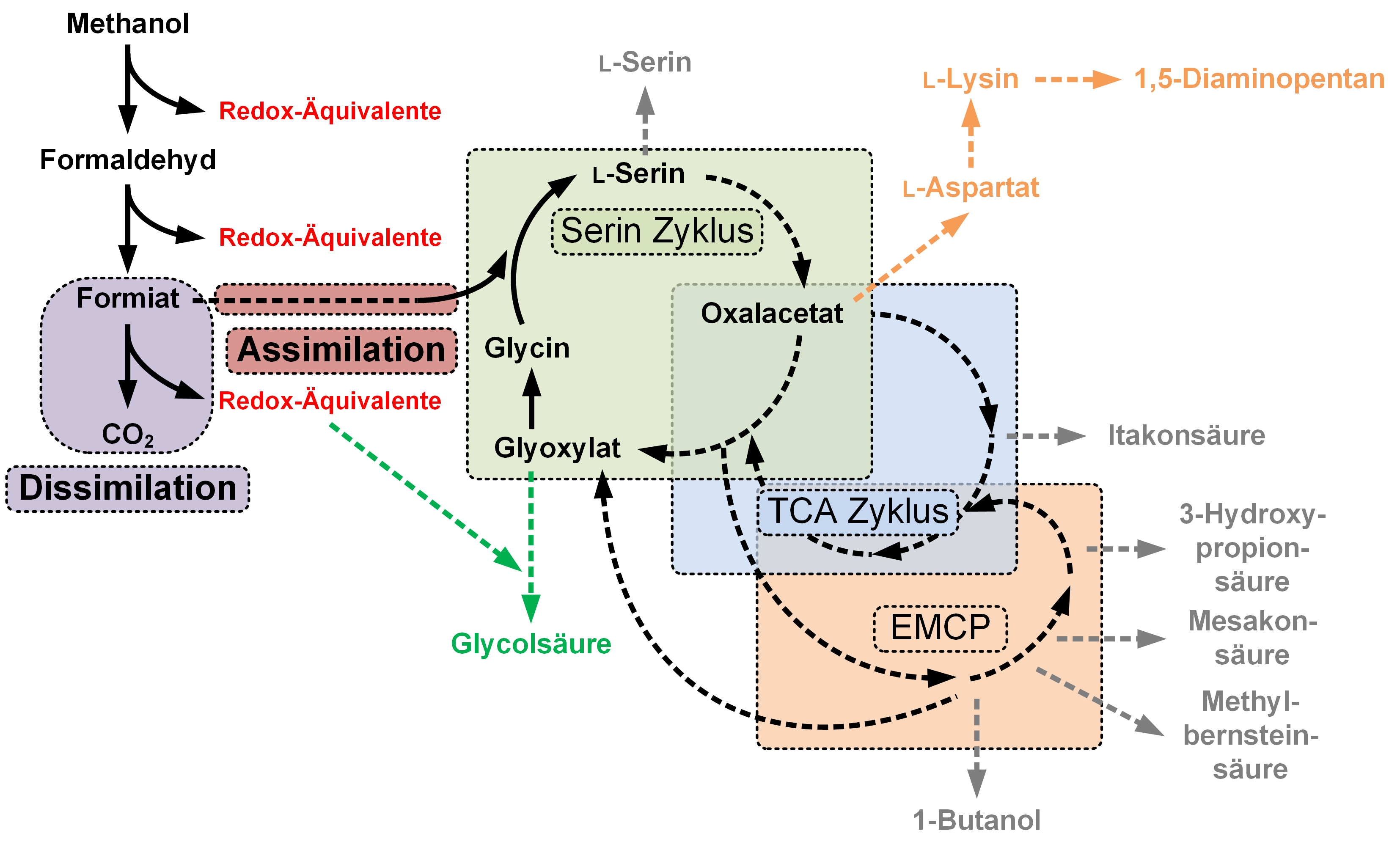
Das konnten wir beispielhaft demonstrieren mit unserem »Haustierchen« Methylorubrum extorquens. Dabei handelt es sich um ein methylotrophes Bakterium, welches sowohl Ameisensäure als auch Methanol verstoffwechseln und für die Wertstoffproduktion nutzen kann. Der Stoffwechsel von M. extorquens ist sehr vielseitig und hat interessante Schnittstellen zur Produktion von verschiedensten Chemikalien (siehe Abbildung 1). Demonstrieren konnten wir bereits die Produktion von zwei relevanten Produkten. Zum einen haben wir die industriell wichtige Aminosäure Lysin herstellen können (Abbildung 1, orange Route). Diese Arbeiten sind Anfang 2024 in der Fachzeitschrift Chemie Ingenieur Technik veröffentlicht worden2 Zum anderen haben wir die Synthese von Glycolsäure3 demonstriert (Abbildung 1, grüne Route). Darüber hinaus gibt es mehrere Arbeiten, die z. B. die Produktion der Aminosäure Serin4 und der organischen Säuren Itakonsäure5, 3-Hydroxypropionsäure6, Mesakonsäure7 und Methylbernsteinsäure7 oder des Lösungsmittels 1-Butanol8 zeigen (Abbildung 1, graue Routen). Alle diese Produkte werden von M. extorquens nicht natürlicherweise hergestellt.
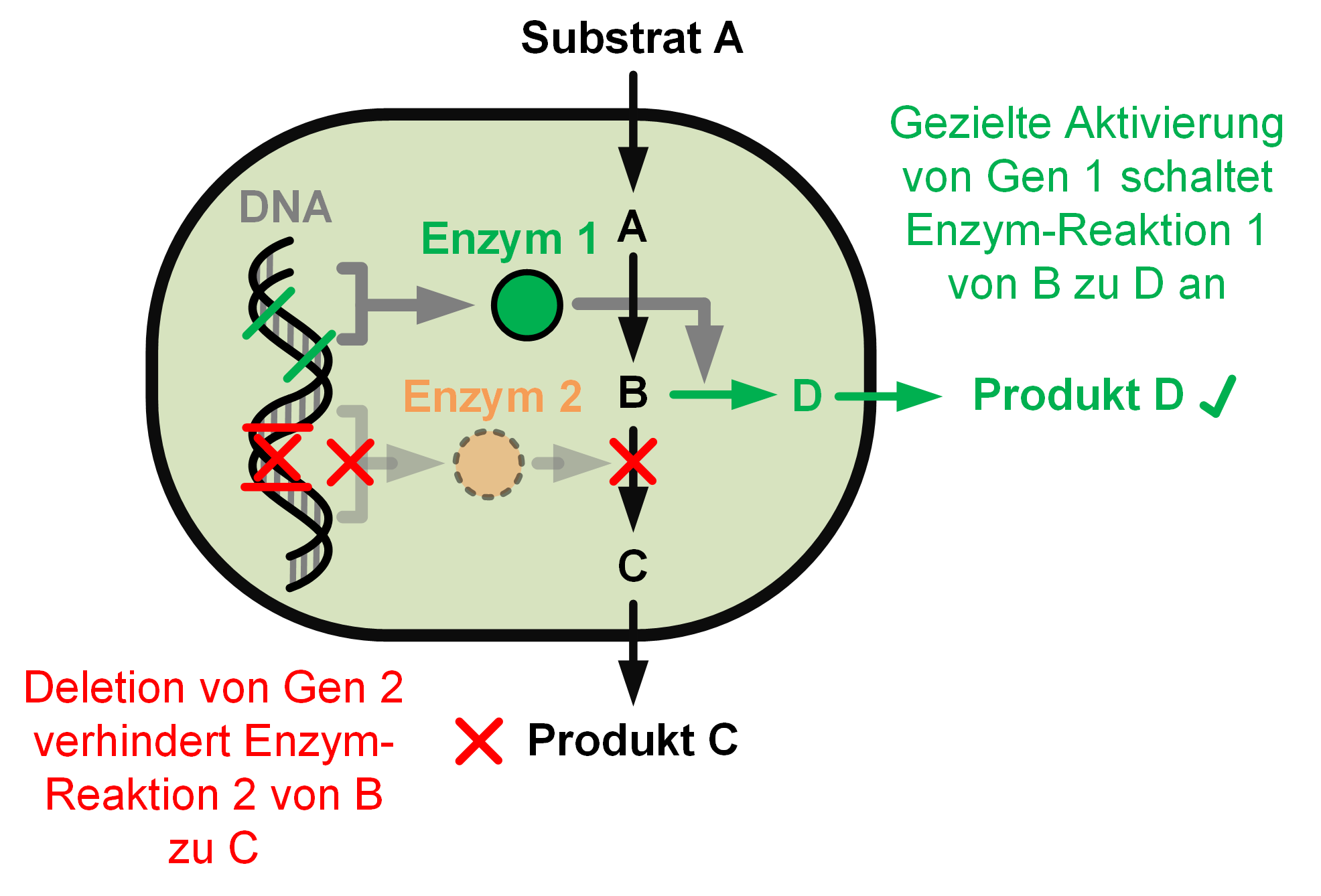
Aber wie bringt man ein Bakterium dazu, das Produkt der Wahl herzustellen, wenn es dieses nicht von Natur aus macht? Dafür wird die Technik des »Metabolic Engineering« genutzt, die in Abbildung 2 zusammenfassend erklärt ist. Die Grundlage dafür sind zahlreiche Methoden die das Genom (das Erbgut) der genutzten Mikrobe technisch verändern und maßgeschneiderte Produktionsstämme für eine Zielchemikalie ermöglichen, die wie eine zelluläre Fabrik arbeiten − kurz: wie eine Zellfabrik.
Glycolsäure als wirtschaftlich relevantes Produkt
Angefangen haben wir mit einer kleinen organischen Säure, der Glycolsäure. Diese C2-Säure ist von industriellem Interesse durch einen sehr breiten Einsatz in der Textilindustrie (Gerben von Stoffen und Leder), im technischen Bereich (Entrostung von Rohren), oder in der Medizintechnik als Ausgangsstoff für die Polymere Poly-Glycolsäure (PGA) und Polylactid-co-Glycolid (PLGA) in Kombination mit Milchsäure. PLGA kann als Nahtmaterial für Wunden eingesetzt werden und löst sich im Körper restlos auf. Das Marktvolumen von Glycolsäure umfasst daher bereits rund eine halbe Milliarde Euro im Jahr 2024. Bisher wird Glycolsäure großtechnisch aus petrochemischem Formaldehyd über die Karbonylierung mit Synthesegas hergestellt.9 Eine nachhaltige Route, die einen erneuerbaren Rohstoff wie CO2-basiertes Methanol nutzt, kann die petrochemische Synthese somit ersetzen und den CO2-Fußabdruck hergestellter Glycolsäure deutlich senken. Das war die Motivation zum Start unserer Studie.
Biotechnologisch kann Glycolsäure mit Hilfe einer Glyoxylat-Reduktase aus Glyoxylat hergestellt werden. Da Glyoxylat im Metabolismus von M. extorquens ein zentrales Zwischenprodukt ist, ist eine biotechnologische Synthese aus Methanol vielversprechend (Abbildung 1).
Digitale Werkzeuge sind heute unerlässlich in der Biotechnologie
Da die genetische Veränderung von Mikroorganismen ein zeit- und ressourcenintensiver Ansatz ist, werden digitale Werkzeuge eingesetzt, um im Vorfeld die Chancen der geplanten Arbeiten abzuschätzen. Ein solches von uns genutztes Werkzeug ist die Metabolische Modellierung. Dabei wird das Stoffwechsel-Netzwerk eines Mikroorganismus in einem mathematischen Modell zusammengefasst. Allgemein kann so ein Netzwerk aus tausenden von chemischen Reaktionen bestehen, die von Enzymen katalysiert werden. Für eine ganzheitliche Bewertung der Netzwerk-Kapazitäten für die Bioproduktion reicht es aber aus, einen Bruchteil dieser Reaktionen zu nutzen.
Diesen Ansatz haben wir verfolgt und das komprimierte Stoffwechsel-Netzwerk von M. extorquens bestehend aus 144 Reaktionen nachgebildet. Dieses komprimierte Netzwerk kann nun mit mathematischen Methoden wie z. B. Fluss-Bilanz-Analyse (FBA) oder Elementar-Flussmodenanalyse (EFMA) untersucht werden10. Hierbei werden die stöchiometrischen Zusammenhänge der chemischen Reaktionsgleichungen des Netzwerkes genutzt. Insbesondere die Anwendung von EFMA ermöglicht die Abschätzung der theoretischen Kapazität des Netzwerks bei einer Umwandlung von Methanol in das Produkt Glycolsäure (Produkt-Substrat-Ausbeute). Mit EFMA werden alle theoretisch möglichen Routen durch das Netzwerk berechnet, die eine minimale Beteiligung einer Kombination von Reaktionen beinhalten.
Durch die Modellierung einer aktiven Glyoxylat-Reduktase ließ sich der Lösungsraum des M. extorquens Netzwerks berechnen und wir konnten eine theoretische maximale Ausbeute von 1 C-mol Glycolsäure pro C-mol Methanol vorhersagen. Das entspricht einer Kohlenstoffausbeute von 100 Prozent. Dies wird ermöglicht durch Eigenschaften des Stoffwechsels von M. extorquens, der in der Methanol-Oxidation entstehendes CO2 wieder einfangen und im Produkt Glycolsäure konservieren kann. Insbesondere die zentrale Stellung des Vorläufermoleküls Glyoxylat im Stoffwechsel ermöglicht diese Konservierung.
Damit haben wir gezeigt, dass die Nutzung von M. extorquens der fermentativen Herstellung von Glycolsäure aus Zuckern (z. B. Glucose) deutlich überlegen sein kann. In glykolytischen Fermentationen kann nämlich nur eine im Vergleich niedrigere Kohlenstoffausbeute von 66 Prozent bei der Glycolsäure-Bildung erzielt werden9. Somit bewerteten wir unseren Ansatz durch den Einsatz eines digitalen Werkzeugs als vielversprechend.
Von der Modellierung in die Realität
Im nächsten Schritt haben wir die Laborarbeiten gestartet: Als erstes wurde untersucht, ob M. extorquens höhere Konzentrationen von Glycolsäure toleriert. Es zeigte sich, dass der Stamm auch in Anwesenheit von bis zu 10 g L-1 Glycolsäure wachsen kann, was eine erhöhte Toleranz zeigt und eine Eignung für die Glycolsäure-Synthese belegte.
Anschließend wurden in einem Screening Glyoxylat Reduktasen aus unterschiedlichen Bakterien in M. extorquens exprimiert und deren Aktivität gemessen, um ein geeignetes Enzym zu finden. Wir konnten zeigen, dass eine hohe Enzymaktivität und die Glycolsäure-Produktion mit einer Glyoxylat-Reduktase vorkommend in Escherichia coli möglich ist11. Dabei sind bereits um die 0.3 g L-1 Glycolsäure aus Methanol hergestellt worden.
Milchsäure – ein unerwartetes Nebenprodukt
Weitere Analysen des entwickelten Stammes in Fermentationsexperimenten zeigten, dass ein unerwartetes Nebenprodukt gebildet wird: Milchsäure. Interessant ist, dass die Milchsäure und Glycolsäure sich in einem nahezu konstanten Verhältnis von je 50 Prozent zueinander bilden. Warum dieses Verhältnis so besteht ist noch unverstanden. Durch die Analyse der Ergebnisse mit dem konstruierten Stoffwechselmodell von M. extorquens, fanden wir Hinweise auf eine erhöhte Verfügbarkeit von Nicotinamidadenindinukleotid(phosphat) (NADH) im modifizierten Stamm. Dieses erhöhte Level von NADH scheint die Lactat-Dehydrogenase zu aktivieren, was zu der beobachteten Milchsäure-Synthese führt.
Auch wenn ein Nebenprodukt in einem fermentativen Prozess unerwünscht ist, so ist die Milchsäure-Bildung für uns interessant. Durch diesen Prozess sind nun nämlich gleichzeitig die zwei Bausteine für die Polymere PGA und PLGA aus Methanol zugänglich. Das macht den entwickelten Stamm wirtschaftlich interessant.
Die Chancen und Hürden der kommenden Arbeiten
In weiteren Arbeiten wurde versucht die Verfügbarkeit von Glyoxylat im Stamm zu erhöhen. Unsere Fütterungs-Experimente haben gezeigt, dass eine künstlich erhöhte Verfügbarkeit von Glyoxylat die Glycolsäure-Produktion in M. extorquens drastisch verbessern kann. Um die Glyoxylat-Verfügbarkeit im Stamm dauerhaft zu erhöhen, sollte ein Schlüsselenzym des Ethylmalonyl-CoA-Stoffwechselwegs (EMCP), die Ethylmalonyl-CoA-Mutase (ECM) überexprimiert werden (Abbildung 1). Es zeigte sich allerdings, dass die getätigten Eingriffe in den Stoffwechsel nicht den erhofften Effekt haben. Es ist bisher noch nicht geklärt ob ein regulatorischer Effekt oder z.B. eine zu geringe Verfügbarkeit an Cofaktoren (wie Metalle oder Vitamine) der EMCP-Enzyme für diese Ergebnisse verantwortlich ist.
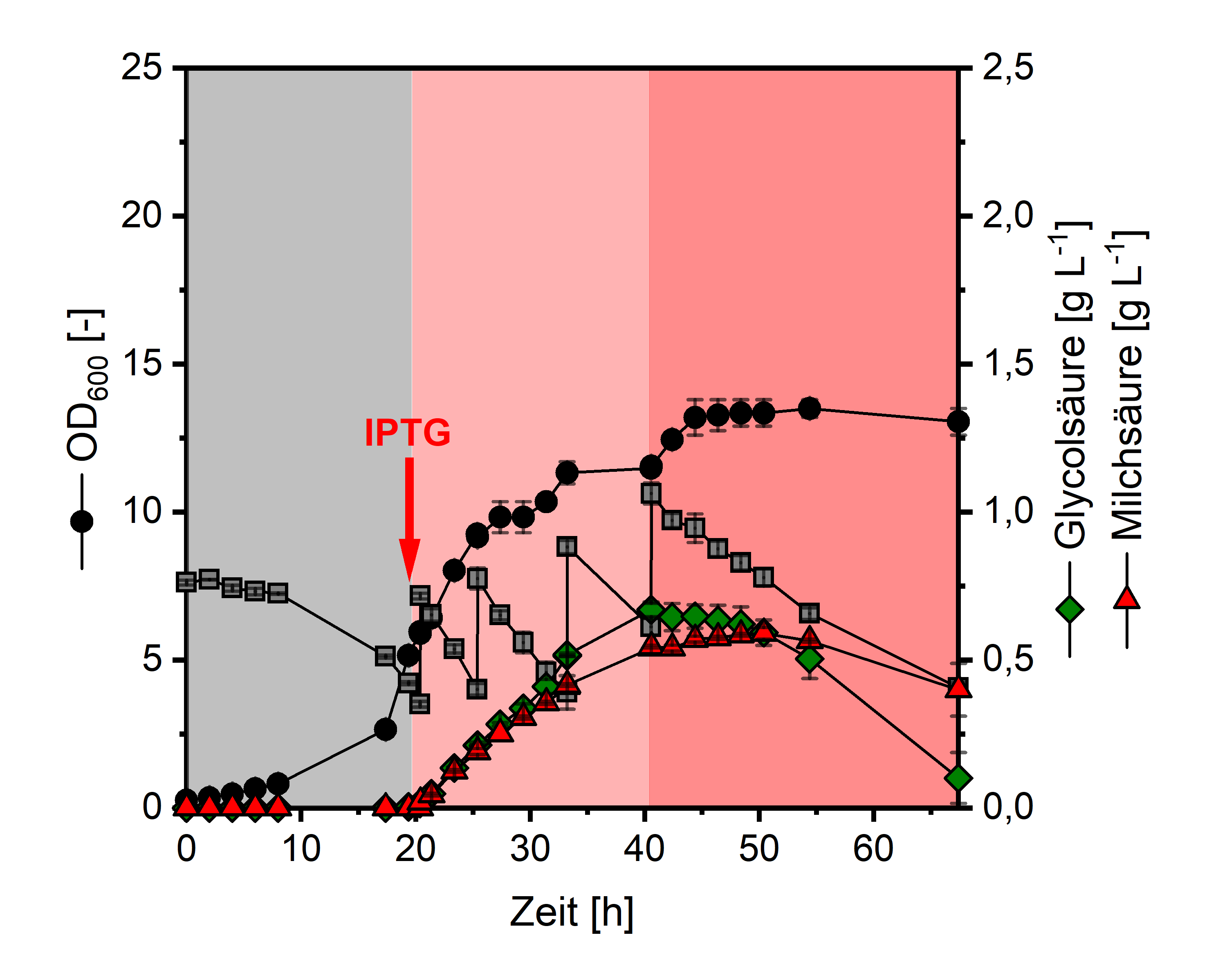
Schließlich wurde der initiale Stamm, der eine Glyoxylat-Reduktase aus E. coli exprimiert, in einer 2L-Fermentation getestet (Abbildung 3). Durch die Fütterung von Methanol ist eine höhere Biomassekonzentrationen erzielt worden und nach 40-stündiger Fermentationsdauer erreichte der Stamm einen Titer von rund 1.2 g L-1 Glycolsäure plus Milchsäure. Dieses Experiment ist vielversprechend und deutet weitere Ansatzpunkte in der Entwicklung an.
Insbesondere die beobachtete Wiederaufnahme der Produkte trotz vorhandenem Methanol muss untersucht und verhindert werden. Dazu muss auch der Stamm selber weiter verbessert werden, um industriell relevante Titer und Produktivitäten für die Zielprodukte zu erreichen. Dafür können aus den Modellierungsergebnissen abgeleitete Stammentwicklungsstrategien getestet werden. Abschließend wird in weiteren Arbeiten die Rolle der Lactat-Dehydrogenase für die beobachtete Milchsäure Synthese experimentell untersucht.
Trotz der offenen Fragen demonstriert unsere Veröffentlichung eine neue Route zu CO2-basierten Bausteinen für die Polymere PGA und PLGA. Wenn diese Entwicklungen für Sie interessant sind, melden Sie sich gerne bei uns. Zusammen können unsere Forschungsergebnisse in die Anwendung gebracht werden.
Verwendete Referenzen:
1 https://www.tagesschau.de/wissen/klima/copernicus-bericht-2024-100.html
2 https://doi.org/10.1002/cite.202400002
3 https://doi.org/10.1186/s12934-024-02583-y
8 https://doi.org/10.1186/s13068-014-0156-0
9 https://doi.org/10.1007/s00253-019-09640-2
10 https://doi.org/10.1016/j.jbiotec.2017.05.001
11 https://doi.org/10.1042/bj3540707