Teil 1: Herausforderungen bei der Herstellung und Potenziale der Automatisierung
Die personalisierte Medizin mit Arzneimitteln für neuartige Therapien (ATMP) ist ein bahnbrechender Meilenstein in der Behandlung komplexer, bislang nicht heilbarer Erkrankungen, allen voran in der Behandlung onkologischer Erkrankungen. Allerdings kommen ATMPs aktuell nur selten zur Anwendung und sind sehr teuer. So kann es nicht blieben! Ein wichtiger Faktor ist hierbei der Herstellungsprozess selbst. Dieser ist zur Zeit noch sehr arbeits- und zeitaufwendig, da er bisher weitestgehend manuell durchgeführt wird. Erste Automatisierungslösungen wollen dem entgegenwirken, stoßen aber auch schnell aus verschiedenen Gründen an ihre Grenzen. Die ATMP-Produktion muss deshalb grundlegend neu gedacht werden, so dass allen Patientinnen und Patienten, die von dieser Therapie profitieren können, der Zugang auch ermöglicht wird. Doch wie schaffen wir das?
Was sind ATMP überhaupt und wozu werden sie genutzt?
Advanced Therapy Medicinal Products – Arzneimittel für neuartige Therapien, abgekürzt ATMP, bieten revolutionäre neue Behandlungsansätze, da sie für den Patienten maßgeschneidert werden können. Die Klasse der ATMP ist sehr komplex. Zu ihnen gehören Zell- und Gentherapeutika sowie biotechnologisch bearbeitete Gewebepräparate und kombinierte Produkte, die Zellen und Gerüststoffe (sogenannte Matrices) kombinieren. ATMP enthalten oder bestehen daher aus lebenden Zellen oder, wenn die Expression oder die Modulation der Expression von Genen intendiert ist, aus Vektoren (Shuttle zum Transfer von Genen) bzw. Nukleinsäuren (DNA oder RNA).
Aktuell fokussiert sich der Großteil der Entwicklungen im ATMP-Bereich auf die Behandlung onkologischer Erkrankungen, eine zweite große Entwicklungswelle zielt auf die Behandlung von Erbkrankheiten ab. Des Weiteren werden ATMP auch im Bereich der regenerativen Medizin, etwa zur Therapie von Knorpel-, Knochen- und Gelenkerkrankungen, entwickelt. Dies sind nur einige Beispiele für die Behandlungsmöglichkeiten, die uns ATMP bieten.
Wir stehen erst am Anfang: Der ATMP-Markt wächst stetig
Noch vor wenigen Jahren wurde die Entwicklung und Herstellung von ATMPs aufgrund des zumeist experimentellen Charakters und fehlender Produktionsstandards fast ausschließlich im klinischen Umfeld verortet. Hierbei handelte es sich zumeist um individuell hergestellte, in kleinen Stückzahlen produzierte Präparate, welche lediglich zur Behandlung seltener und zumeist schwerer Krankheiten eingesetzt wurden. Jedoch hat die Entwicklung von ATMPs zuletzt enorme Fortschritte gemacht.
Die stetig ansteigende Relevanz von ATMP lässt sich beispielsweise sehr gut anhand der zunehmenden Verwendung von CAR-T-Zellen beobachten. Ursprünglich wurden diese für die Behandlung von B-Zell-Leukämien entwickelt. Mittlerweile hat sich der Anwendungsbereich jedoch stark vergrößert. Sie können unter anderem auch zur Erkennung von infizierten Zielzellen verwendet werden, welche virale Antigene auf der Oberfläche tragen, oder zur Eliminierung von pathogenen B-Zellen und sogar gegen autoreaktive T-Zellen eingesetzt werden.
Auch die Analyse der aktuell laufenden klinischen Studien zeigt, dass das Feld im Wandel ist. Von Jahr zu Jahr steigt nicht nur die Anzahl weltweit durchgeführter klinischer Studien, sondern auch die Anzahl unterschiedlicher Produkttypen sowie das Indikationsspektrum. Vertreter der US-Behörde für Lebens- und Arzneimittel, Food and Drug Administration, kurz FDA, und der Europäischen Arzneimittelagentur EMA haben sogar vorausgesagt, dass sie bis 2025 jeweils 10 bis20 Zell- und Gentherapien pro Jahr genehmigen werden.
Die CAR-T-Zell-Therapie als Paradebeispiel für die Anwendung von ATMP
Die CAR-T-Zell-Therapie besteht aus der Infusion von gentechnisch veränderten T-Zellen, die einen künstlich hergestellten chimären Antigenrezeptor (CAR) auf der Zellmembran tragen. Der äußere Teil dieses Rezeptors ist darauf ausgelegt, ein spezifisches Molekül auf einer Zielzelle zu erkennen. Wenn dies geschieht, wird die interne Signaldomäne des CAR-Rezeptors aktiviert und die T-Zelle dazu angeregt, die Zielzelle anzugreifen.
Man unterscheidet hier zwischen autologen Zellprodukten, bei denen patienteneigene Zellen verwendet werden, und allogenen Zellprodukten, bei denen Zellen einer anderen Spenderin oder eines anderen Spenders eingesetzt werden. Die Herstellung von CAR-T-Zellen beginnt mit der Entnahme von T-Zellen aus der zu behandelnden Person bzw. einer gesunden spendenden Person, einem Prozess, der Leukapherese genannt wird. Die T-Zellen werden dann genetisch so verändert, dass sie das CAR-Molekül exprimieren, und im Anschluss expandiert. Nach der Expansion werden die Zellen geerntet sowie formuliert und schließlich der Patientin oder dem Patienten mittels Infusion verabreicht.
Aktuelle Produktionsverfahren
Eine der größten Herausforderungen im ATMP-Bereich sind die enorm hohen Entwicklungs- und Herstellungskosten. So kostet die Verabreichung einer Dosis Kymriah (erstes zugelassenes CAR-T-Zelltherapeutikum für die Behandlung akuter lymphatischer Leukämie und des Non-Hodgkin-Lymphoms) ca. 275 000 €. Diese hohen Behandlungskosten werden unter anderem durch die oft sehr langen Entwicklungszeiten und hohen Entwicklungsrisiken sowie die aufwendigen klinischen In-vivo-Studien verursacht. Ein weiterer relevanter Kostentreiber ist die Produktion selbst. Für die ATMPs gibt es bisher noch keine standardisierten Herstellverfahren. Ein Grund hierfür ist die Komplexität dieser Produktklasse und die damit einhergehenden unterschiedlichen Anforderungen an die Produktion.
Die meisten Zell- und Gentherapieprodukte werden in Handarbeit in großen Reinraumstrukturen hergestellt. Die Komplexität und die Kosten der Herstellung, die mit solchen arbeitsintensiven manuellen Produktionsprozessen verbunden sind, lassen sich nur schwer skalieren. Während diese Art der Herstellung für präklinische und erste klinische Untersuchungen noch durchgeführt werden kann, ist für das Erreichen fortgeschrittener Phasen der klinischen Entwicklung und Kommerzialisierung eine Industrialisierung mittels automatisierter Methodik von größter Bedeutung. Hier kommen bereits heute eine Reihe mechanisierter und automatisierter Geräte zum Einsatz, die verschiedene Prozessschritte oder gar einen spezifischen Prozess in seiner Gesamtheit abdecken. Die Heterogenität der verschiedenen Produkte spiegelt sich dabei in einem breiten Portfolio an Technologien wider. Diese geraten allerdings hinsichtlich der Skalierbarkeit wirtschaftlich schnell an ihre Grenzen und erlauben im Sinne eines Plattformcharakters keine horizontale Transferierbarkeit.
Innovative Ansätze und neue Technologien sind jetzt gefragt
Da der Bedarf des stetig anwachsenden ATMP-Marktes mit den aktuellen Herstellungsverfahren perspektivisch nicht gedeckt werden kann und die Behandlung bisher schlichtweg zu teuer ist, wird die Entwicklung neuer Ansätze und Technologien zu einer Priorität. Die Produktionstechnik im Allgemeinen und die Automatisierung sowie Digitalisierung im Besonderen nehmen dabei neben den Prozesstechnologien eine wichtige Rolle ein.
Doch wie sollte die zukünftige industrielle ATMP-Herstellung aussehen? Wir am Fraunhofer IPA in der Abteilung Laborautomatisierung und Bioproduktionstechnik stellen folgende Anforderungen an das zukünftige Produktionssystem:
- Vollautomatisiert und integriert
- Transferierbare, geschlossene Prozesse
- Adaptierbare Systeme
- Vollständige Inline-/Online-Analytik
- Selbstoptimierend und lernend
- Dezentralisierte biointelligente Herstellsysteme
Um dies zu erreichen, setzen wir auf eine modulare Architektur, die auf standardisierten und vernetzbaren Prozesseinheiten basiert. Dabei handelt es sich um ein System, welches – im Sinne einer Plattform – diverse Operationen auf einzelnen Prozessmodulen umsetzt. Dies erfordert eine Ausrichtung der Produktion nach neuesten Standards im Sinne von Industrie 4.0. Gefragt sind ein intelligentes und vernetztes System zur Echtzeitüberwachung, Simulation und Steuerung von Fertigungsprozessen. Die Basis, die allen Prozessen zugrunde liegt, sind die Daten der miteinander verbundenen Systeme. Mit einem hochtechnologischen System können die Fertigungsprozesse sich automatisiert ständig selbst anpassen.
Perspektivisch bietet die modulare Automatisierung in Verbindung mit selbstoptimierenden und lernenden Softwarelösungen wie Künstliche-Intelligenz-Algorithmen einen nachhaltigen kosten- und zeiteffizienten Ansatz, um die Herstellung von ATMPs in Zukunft zu optimieren und zu maximieren und damit den Bedarf an ATMPs zu decken.
Die Potenziale einer automatisierten und digitalisierten ATMP-Produktion
Im Sinne einer nachhaltigen und konkurrenzfähigen Produktion wird in Zukunft kein Marktteilnehmer auf die Vorteile einer automatisierten und digitalisierten ATMP-Herstellung verzichten können. Die signifikante Reduktion der Personalkosten bei gleichzeitiger Steigerung der Produktqualität und -sicherheit werden die Rentabilität dieser Therapeutika beträchtlich steigern. In einer automatisierten, modular aufgebauten Prozessstraße mit automatischer Reinigungsanlage könnten dann sogar mehrere Prozesse in einer einzigen Produktionsstätte stattfinden, wodurch die ATMP-Herstellung sowohl umwelt- als auch ressourcenschonend durchgeführt werden könnte.
Darüber hinaus können mit der Automatisierung und Digitalisierung wertvolle Personalressourcen freigesetzt werden. Laborpersonal, welches bisher für die zeitaufwendigen manuellen Herstellverfahren benötigt wurde, hat so die Möglichkeit, neue Forschungs- und Entwicklungsideen auszuarbeiten und diese im Labor zu testen und voranzubringen (siehe Graphik).
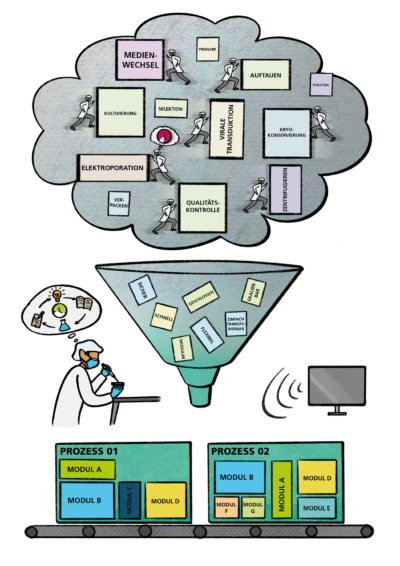
Dies sind nur Beispiele von möglichen Potenzialen, die sich durch ein neues Produktionskonzept im ATMP-Feld ergeben könnten. Welche Potenziale sehen Sie? Hinterlassen Sie gern einen Kommentar.
Wie der Weg hin zu einer modularen automatisierten und digitalisierten ATMP-Produktion in der Zukunft aussehen kann, was für Kerntechnologien dafür benötigt werden und wie man diese in die Realität umsetzen kann, wird die Blog-Reihe »Modulare Minifabriken – Produktion von Arzneimitteln für neuartige Therapien neu gedacht« untersuchen. Also bleiben Sie dran!
Im Text verwendete Quellen:
- https://alliancerm.org/sector-report/2019-annual-report/
- https://alliancerm.org/wp-content/uploads/2019/10/Trends-in-Clinical-Trials-2019-Final_Digital.pdf
- https://alliancerm.org/sector-report/2020-annual-report/
- https://www.g-ba.de/downloads/92-975-3671/2020-03-13_Modul3B_Tisagenlecleucel.pdf
- https://www.pharmazeutische-zeitung.de/herausforderungen-chancen-und-risiken/

