Um mit Krankheitserregern zurecht zu kommen, hat unser Körper ein wirksames Arsenal an Gegenmaßnahmen zur Verfügung. Ein wesentlicher Bestandteil ist das angeborene Immunsystem. Dessen Komponenten und Mechanismen lassen sich nutzen und nachbilden, um etwa Testsysteme für eine effiziente Diagnostik von Erkrankungen herzustellen. Auch Wirkstoffe können damit effektiv gescreent und identifiziert werden. So wird die natürliche Kompetenz des Körpers biointelligent nutzbar gemacht.
Das angeborene Immunsystem ist die erste Verteidigungslinie des menschlichen Körpers gegen Krankheitsverursacher wie Bakterien und Viren. Diese sogenannten Pathogene besitzen molekulare Muster (pathogen-associated molecular patterns, PAMPs), auch bekannt als Pyrogene. Die PAMPs werden von spezifischen Rezeptoren (pattern recognition receptors, PRRs) bestimmter Zellen des angeborenen Immunsystems erkannt und führen damit zur Auslösung einer Immunreaktion. Die bekanntesten PRRs sind die Toll-like-Rezeptoren (TLRs).
Im Menschen gibt es zehn verschiedene TLRs, die durch unterschiedliche PAMPs spezifisch aktiviert werden. Beispielsweise aktivieren Lipopolysaccharide (LPS), Bestandteile der äußeren Membran gramnegativer Bakterien und wohl bekannteste PAMPs, den TLR4. Darüber hinaus spielen TLRs in vielen akuten und chronischen Erkrankungen, zum Beispiel bei der Schuppenflechte, eine Schlüsselrolle.
Die spezifischen Bindungseigenschaften der TLRs machen sie zur idealen Toolbox, um zum Beispiel Mikroorganismen und deren Bestandteile (Pyrogene) zu identifizieren. Außerdem werden TLRs vielfach in der Diagnostik und bei Testsystemen sowie als Targets für die Suche nach neuen Medikamenten eingesetzt. Bei dieser Medikamentenentwicklung werden einerseits Substanzen erforscht, die an einem oder mehreren TLRs binden und eine Immunreaktion auslösen, sogenannte Agonisten, und andererseits Substanzen, die die Bindung an TLRs hemmen oder verhindern, sogenannte Antagonisten.
Entwicklung von Reporterzelllinien mit unterschiedlichen TLR-Kombination
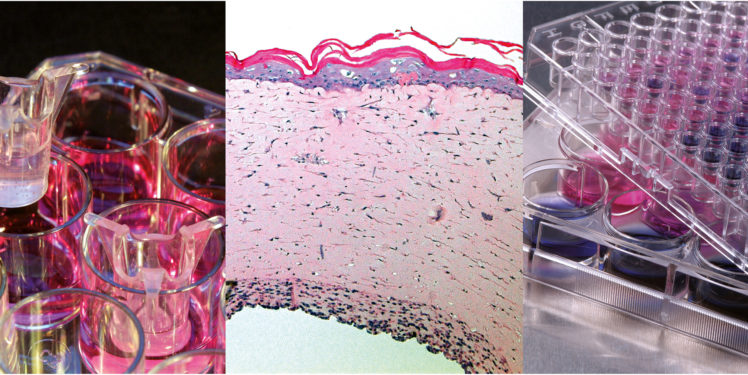
Am Fraunhofer IGB arbeitet die Abteilung von Dr. Anke Burger-Kentischer seit mehr als 15 Jahren an der Entwicklung von zweidimensionalen und dreidimensionalen Testsystemen zum Nachweis und zur Identifikation von PAMPs mittels TLRs. Die Grundlage dieser Testsysteme ist die Etablierung von Reporterzelllinien, die individuelle TLRs bzw. TLR-Kombinationen exprimieren. Dafür wird eine Zelllinie mit einem TLR, oder einer TLR-Kombination, sowie einem Reportergen stabil transfiziert, sodass die einzelne Zelle diesen TLR auf ihrer Oberfläche präsentiert. Kommt es zur Bindung eines PAMP am TLR der transfizierten Zelle, wird der TLR aktiviert und eine Signalkaskade im Inneren der Zelle ausgelöst, die schließlich zur Aktivierung von Transkriptionsfaktoren führt.
Diese Transkriptionsfaktoren aktivieren dann die Expression des Reportergens, beispielsweise eine alkalische Phosphatase, welche von den Zellen sekretiert wird. Durch die Zugabe eines für die alkalische Phosphatase geeigneten Substrates kann die Aktivierung der angeborenen Immunrezeptoren einfach und schnell photometrisch gemessen werden. Dieses In-vitro-Testsystem stellt das menschliche angeborene Immunsystem stark vereinfacht nach und kann damit als Nachweis- und Testsystem optimal eingesetzt werden.
Reporterzelllinien-Testsysteme – vom einfachen zellulären 2D Assay zum komplexen Gewebe
Die Reporterzelllinien können zweidimensional in Mikrotiterplatten kultiviert und mit Proben, beispielsweise aus der Qualitätskontrolle von Pharmazeutika und Lebensmitteln, inkubiert werden. Nach der Proben-Inkubation wird im Medienüberstand der Zellen die Reportergen-Expression ausgelesen. Dieses zweidimensionale Testsystem (PAMP-Assay) ist patentiert und kann auch GLP-zertifiziert (Good Laboratory Practice, Prüfkategorie 9) durchgeführt werden. Darüber hinaus stehen am Fraunhofer IGB viele Reporterzelllinien für den PAMP-Assay mit unterschiedlichen TLR(-Kombinationen) zur Verfügung: TLR1/2 und TLR2/6 zum Nachweis von Pyrogenen grampositiver Bakterien, TRL4/CD14 zum Nachweis von Endotoxinen gramnegativer Bakterien, TLR5 zum Nachweis von Geißelbakterien, TLR7 zum Nachweis einzelsträngiger viraler RNA und TLR9 zum Nachweis bakterieller DNA.
Eine weitere Anwendung des PAMP-Assays ist die Identifikation von TLR-Agonisten und -Antagonisten. TLR-Agonisten können eingesetzt werden, um das angeborene Immunsystem zu stimulieren, damit der Körper eine Krankheit besser bekämpfen kann. TLR-Antagonisten werden hingegen für die Behandlung von Autoimmunkrankheiten eingesetzt, indem sie die Überreaktion des Immunsystems unterdrücken. Ein aktuelles Beispiel für den Einsatz von TLR-Antagonisten sind die bereits zugelassenen mRNA-Impfstoffe gegen SARS-CoV-2: In der modifizierten Impfstoff-mRNA wurde das Nukleosid Uridin durch N1-Methylpseudouridin ausgetauscht. Diese mRNA-Modifizierung führt dazu, dass die mRNA nicht durch TLRs erkannt wird und verbessert damit die Effizienz der Impfung.
Die Komplexität der zweidimensionalen TLR-basierten Testsysteme konnten wir durch den Einsatz von Fibroblasten-Reporterzelllinien in dreidimensionalen Hautmodellen erhöhen und die sogenannten Reporterhautmodelle etablieren. Neben dem Nachweis von PAMPs über die Bindung an TLRs kann in den Reporterhautmodellen die Membrandurchgängigkeit und Hautpenetrationsfähigkeit neuer Wirkstoffe in vitro evaluiert werden. Darüber hinaus können diese Reporterhautmodelle als In-vitro-Modell für Hautallergien und Hautsensibilisierungen genutzt werden. Die Reporterhaut ist, wie der PAMP-Assay, patentiert.
ImmuStick – ein zellfreier PAMP-Schnelltest
Eine zellfreie Anwendung von TLRs stellt der patentierte ImmuStick dar: Ein PAMP-Schnelltest in Form eines Teststreifens. Mithilfe des ImmuSticks können Mikroorganismen und ihre Rückstände (PAMPs) innerhalb weniger Minuten und ohne die Ausstattung eines Labors nachgewiesen werden. Wie der PAMP-Assay eignet sich der ImmuStick als Schnelltest für die PAMP-Detektion in Medizinprodukten, Pharmazeutika, Kosmetika und Lebensmitteln. Die Vorteile des Schnelltests sind eine einfache und kostengünstige Durchführung. Das patentierte ImmuStick-Konzept entwickeln wir am Fraunhofer IGB im Auftrag und in Kooperation mit unseren Kunden aus dem Medizinbereich weiter und passen es auf die gewünschten spezifischen Anwendungen an.
TLR-basierte Testsysteme: Anforderungsspezifische Detektion und Identifikation
Die am Fraunhofer IGB von Dr. Anke Burger-Kentischer und ihren Mitarbeiter*innen etablierten TLR-basierten Testsysteme sind vielfältig einsetzbar. Sie ermöglichen den Nachweis sowie die Identifikation von PAMPs. Je nach Anwendung können die Assays qualitativ oder quantitativ sowie in unterschiedlichen Qualitätsstandards, von den Anforderungen in der Forschung und Entwicklung bis hin zum zertifizierten GLP-Standard, durchgeführt werden.
Gern beraten wir Sie über Anwendungsmöglichkeiten unserer TLR-basierten Testsysteme und entwickeln sie mit Ihnen für Ihre spezifische Anwendung weiter – Sie können uns jederzeit kontaktieren.